Крутов В.И. Методические указания по расчету горения газообразного топлива - файл n1.doc. Расчет горения топлива
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Российский химико-технологический университет
имени Д.И. Менделеева
Е.М. Акимова, С.А. Першиков
Расчеты горения топлива.
Методические указания к выполнению курсового проекта
Москва 2006
Составители: Е.М. Акимова, С.А. Першиков
УДК 66.041.001.24(075)
БКК 24.54:34.35
Рецензент
Канд. техн. наук, доцент кафедры ХТКиО Российского химико-технологического университета им. Д.И. Менделеева
Ю.М. Мосин
Расчеты горения топлива. Методические указания к выполнению курсового проекта/ Сост. Е.М. Акимова, С.А. Першиков. – М.: РХТУ им. Д.И. Менделеева, 2006. – 28 с.
УДК 66.041.001.24(075)
БКК 24.54:34.35
© Российский химико-технологического университет им. Д.И. Менделеева
© Е.М. Акимова, С.А. Першиков
Введение
Расчеты горения топлива производят для определения необходимого для горения расхода воздуха, количества дымовых газов, их состава и температуры. Если данное топливо не обеспечивает необходимые температуры в печи, то рассчитывают температуру подогрева воздуха, участвующего в горении. Расход воздуха на горение и объем дымовых газов в этих расчетах отнесены к единице массы (1 кг) твердого или жидкого топлива или к единице объема (1 нм 3) газообразного топлива, т.е. являются удельными величинами.
Выбор топлива
При проектировании промышленного предприятия выбор топлива для тепловых агрегатов производят на основе технико-экономических расчетов.
Твердое топливо обычно используют для отопления печей как дешевое местное топливо и только при условии, что обрабатываемый материал (например, цементный клинкер) допускает загрязнение негорючей золой.
Жидкое топливо обладает наиболее высокой теплотворной способностью по сравнению с другими видами, оно – самое дорогое и рассматривается в настоящее время как вспомогательное (резервное) топливо.
Природный газ различных месторождений сочетает высокую теплотворную способность с умеренной ценой и отсутствием золы. Его применение целесообразно в любых тепловых агрегатах. Однако газ дает прозрачное пламя, которое излучает тепло менее интенсивно, чем пламя от сжигания угольной пыли или мазута.
Пересчеты составов топлива
Основой расчетов горения топлива является его состав. В горении участвует только часть топлива, которая называется горючей массой . Непосредственно на горение поступаетрабочее топливо , которое содержит помимо горючей массы влагу, а твердое и жидкое топливо – золу.
Состав топлива для выполнения расчетов может быть взят по результатам анализа или из справочника (см. Приложение, табл. 1–3). Однако необходимо учитывать, что для газообразных топлив состав приводится на сухой газ (включая негорючие компоненты), для твердых и жидких топлив – на горючую массу, реже на рабочее топливо.
Обычно, зная состав горючей массы топлива и принимая по данным анализа или по справочнику содержание золы (А с , %) в сухом топливе и влаги (W р , %) в рабочем топливе, пересчитывают все топливо на рабочую массу.
|
А
р
= А
с
|
|
С
р
= С
г
|
где С р – содержание отдельной составляющей рабочей массы топлива, % (здесь – углерод),С г – содержание той же составляющей горючей массы топлива, %.
Сухое газообразное топливо пересчитывают на влажный газ, который подлежит сжиганию. В природном газе содержится небольшое количество влаги, примерно 0,5÷1,5%, так как при транспортировании газа он подвергается очистке от примесей и большей части влаги.
Часто сумма процентных содержаний компонентов сухого газообразного топлива не равна 100%. Тогда содержание каждого компонента во влажном рабочем газе, например СН 4 вл, рассчитывают по формуле:
где
 – сумма концентраций компонентов сухого
топлива (без учета содержания Н 2 О).
– сумма концентраций компонентов сухого
топлива (без учета содержания Н 2 О).
4.7. Расчет горения органического топлива
Расчет сводится к определению количества воздуха, необходимого для полного сгорания топлива, продуктов горения, а также температуры и энтальпии дымовых газов. Расчет твердого и жидкого топлива ведут по соотношениям масс веществ, участвующих в реакциях, а для газообразного топлива – по объемным соотношениям.
Для полного сжигания 1 кг углерода С требуется 1,866 м 3 кислорода О 2 , в результате чего образуется 1,866 м 3 двуокиси углерода СО 2 и выделяется 34 МДж (34 000 кДж) теплоты:
С + О 2 = СО 2 + Q .
Для полного сгорания 1 кг серы S требуется 0,7 м 3 кислорода О 2 , в результате образуется 0,7 м 3 сернистого газа SО 2 и выделяется 10,5 МДж теплоты:
S + О 2 = SО 2 + Q .
Для полного сгорания 1 кг водорода Н 2 требуется 5,6 м 3 кислорода О 2 , образуется 11,2 м 3 водяного пара Н 2 О и выделяется 121,5 МДж теплоты:
2Н 2 + О 2 = 2Н 2 О + Q .
Для полного сгорания 1 м 3 метана СН 4 требуется 9,52 м 3 воздуха V о, образуется 10,52 м 3 дымовых газов, содержащих СО 2 и водяные пары Н 2 О, и выделяется 36,5 МДж теплоты:
СН 4 + 2О 2 = СО 2 + 2Н 2 О + Q .
При полном сгорании топлива дымовые газы содержат углекислый газ СО 2 , сернистый газ SО 2 , азот топлива и воздуха N 2 , неиспользованный при горении кислород О 2 воздуха, водяной пар Н 2 О, полученный за счет окисления водорода топлива, испарения влаги, содержащейся в топливе и внесенной с влажным воздухом и при распылении жидкого топлива (в паромеханических форсунках).
Для полного горения топлива необходимы: достаточное количество воздуха; хорошее перемешивание воздуха с топливом; высокая температура в топке (не менее 700 °С на выходе); достаточное время пребывания топлива и окислителя в топке; постоянный отвод продуктов сгорания из топки.
При неполном сгорании топлива образуются вредные для человека и окружающей среды оксиды азота (NО, NО 2), серы (SО 2), углерода СО (угарный газ), а также сажа, которая осаждается на экранных и конвективных трубах, снижает теплопередачу от топочных газов к теплоносителю, что приводит к уменьшению КПД и перерасходу топлива. Кроме того, сажа может самовозгораться, что приводит к авариям.
Полнота сгорания топлива определяется двумя способами:
1) с помощью газоанализаторов – по показаниям состава уходящих топочных газов оценивается полнота сгорания и избыток воздуха;
2) визуально – по цвету пламени и дыма. При полном сгорании цвет пламени в разогретой топке голубовато-фиолетовый или прозрачно-соломенный, а цвет дыма – бесцветный, прозрачный, невидимый для глаза – летом и светло-серый или белый – зимой. При неполном сгорании цвет пламени оранжево-красный, с темными язычками, непрозрачный, а цвет дыма – серый ближе к темному, непрозрачный.
Энтальпия воздуха и продуктов сгорания зависит от объема, теплоемкости и температуры компонентов горения и вычисляется по формулам, после чего строится график зависимости энтальпии от температуры топочных газов для каждого элемента котла (топки, газоходов, пароперегревателя, экономайзера и т.п.).
Различают теоретическую (калориметрическую) и действительную температуру горения топлива.
Максимальную температуру, развиваемую при сжигании топлива, называют жаропроизводительностью топлива. Теоретическая – это та температура, которую приобрели бы дымовые газы, если бы вся теплота от полного сгорания топлива воспринималась бы только дымовыми газами. Калориметрическую температуру горения определяют из уравнения теплового баланса. В реальных условиях горения топлива действительная температура топочных газов всегда ниже теоретической за счет теплообмена между топочными газами и радиационными поверхностями нагрева, а также различных потерь теплоты в топке (механический, химический недожог и др.).
4.8. Коэффициент избытка воздуха
Для обеспечения полного сгорания топлива в топочное устройство подводят воздуха больше, чем теоретически необходимо. Отношение действительно поступившего количества воздуха V д к теоретически необходимому V о, называется коэффициентом избытка воздуха α т.
Топки паровых и водогрейных котлов, как правило, работают с разрежением 2…3 мм вод. ст., в связи с чем происходит подсос воздуха и в топку и во все элементы котельной установки по ходу газового тракта, вплоть до дымососа. Присосы воздуха для каждого элемента котла определяются по и ориентировочно могут быть приняты:
0,05 – для первого конвективного пучка (газохода), фестона (с камерой догорания), пароперегревателя, воздухоподогревателя;
0,1 – для второго конвективного пучка (газохода), конвективной шахты, чугунного и стального экономайзера с обшивкой;
0,15…0,2 – для чугунного экономайзера без обшивки.
Поэтому коэффициент избытка воздуха в уходящих топочных газах – αух больше чем в топке, на суммарное значение присосов воздуха ΣΔα и составляет:
α ух = α т + ΣΔα.
Разрежение в топке замеряется тягонапоромером ТНЖ. При разрежении менее 1 мм вод. ст. топочные газы могут выбиваться в помещение котельной, что недопустимо по технике безопасности. При разрежении более 8 мм вод. ст. будет происходить значительный подсос холодного наружного воздуха, что приведет к снижению температуры топочных газов, увеличению потерь теплоты, снижению КПД и др.
5. Тепловой баланс теплогенератора
5.1. Уравнение теплового баланса
Расход сжигаемого топлива должен обеспечивать получение необходимого количество полезной теплоты, а также восполнение тепловых потерь, сопровождающих работу котельной установки. Полезно используемая теплота в котельной установке Q 1 идет на подогрев воды, ее испарение, получение и перегрев пара. Соотношение, связывающее приход и расход теплоты, носит название теплового баланса .
Тепловой баланс составляется на 1 кг твердого или жидкого топлива, на 1 м 3 газообразного топлива или в % от введенной теплоты. Суммарное количество введенной в топку теплоты называется располагаемой теплотой Q р р и соответственно включает в себя:
Q р н – низшую рабочую теплоту сгорания топлива;
Q ф.т – физическую теплоту, вводимую в теплогенератор с топливом, если топливо предварительно нагревается (мазут);
Q ф.в – физическую теплоту, вводимую в теплогенератор с воздухом, если нагрев воздуха происходит вне котельного агрегата (воздухоподогреватель);
Q пар – физическую теплоту, вводимую в теплогенератор с паром, при паровом распылении топлива (паромеханические форсунки).
Следовательно,
Q р р = Q р н + Q ф.т + Q ф.в + Q пар.
Расходная часть теплового баланса Q расх включает в себя полезно использованную теплоту Q 1 , а также потери теплоты с уходящими топочными газами Q 2 , химической Q 3 и механической Q 4 неполнотой сгорания топлива, от наружного охлаждения Q 5 , с физической теплотой шлаков Q 6 , на аккумуляцию ограждающих конструкций Q ак (при нестационарных условиях работы установки). Следовательно,
Q расх = Q 1 + Q 2 + Q 3 + Q 4 + Q 5 + Q 6 + Q ак.
Уравнение теплового баланса имеет вид
Q р р = Q расх.
Разделив, каждый член уравнения теплового баланса на Q р р и умножив на 100 %, получим другую запись уравнения теплового баланса:
100 = q 1 + q 2 + q 3 + q 4 + q 5 + q 6 .
5.2. Коэффициент полезного действия и расход топлива
теплогенератора
Коэффициентом полезного действия брутто η бр, %, называется отношение полезно используемой теплоты Q 1 к располагаемой Q р р:
η бр = (Q 1 / Q р р) ⋅ 100, %.
Доля полезно используемой теплоты
q 1 = (Q 1 / Q р р) 100, %.
Тогда имеем, что q 1 = η бр.
Следовательно, коэффициент полезного действия брутто
η бр = 100 − (q 2 + q 3 + q 4 + q 5 + q 6), %.
При выработке тепловой энергии следует учитывать расход тепловой энергии на собственные нужды q с.н (привод насосов, тягодутьевых устройств, на обдувку, деаэрацию, мазутное хозяйство и т.д.). В связи с этим введено понятие КПД нетто
η нетто = η бр − q с.н, %.
Натуральный расход топлива В н, кг/с, м 3 /с, при нормальных условиях сжигания (при t = 0 °С и Р = 760 мм рт. ст.), в паровом и водогрейном котельном агрегате определяется по формулам:
Для парового котла
В н = (D Δi п) / (Q р р η бр),
Для водогрейного котла
В н = (G Δi в) / (Q р р η бр),
где D – паропроизводительность теплогенератора, кг/с; Δi п – прирост энтальпии пара и питательной воды, кДж/кг; Q р р – располагаемая теплота, кДж/кг, кДж/м 3 ; η бр – КПД брутто; G – расход воды через водогрейный котел, кг/с; Δi в – прирост энтальпии горячей и холодной воды, кДж/кг.
При сжигании газа и мазута, расчетный расход топлива В р равен натуральному расходу В н, так как потери теплоты от механической неполноты сгорания q 4 = 0.
Для увеличения ηбр необходимо снижать потери теплоты, а именно:
Работать по режимной карте, температурному графику, с наименьшим коэффициентом избытка воздуха: 1,05…1,1 – для природного газа; 1,1…1,15 – для мазута; 1,4…1,8 – для твердого топлива;
Следить за температурой уходящих топочных газов, полнотой сгорания топлива, обмуровкой котла.
5.3. Тепловые потери теплогенератора
Работа теплогенерирующей установки сопровождается потерями теплоты, выраженными обычно в долях, %:
q i = (Q i / Q р р) ⋅ 100.
1. Потери теплоты с уходящими топочными газами теплогенератора
q 2 = (Q 2 / Q р р) ⋅ 100, %.
В теплогенераторе это, чаще всего, наибольшая часть тепловых потерь. Потери теплоты с уходящими топочными газами можно понизить за счет:
Снижения объема дымовых топочных газов, путем поддержания требуемого коэффициента избытка воздуха в топке α т и уменьшения присосов воздуха;
Снижения температуры уходящих топочных газов, для чего применяют хвостовые поверхности нагрева: водяной экономайзер, воздухоподогреватель, контактный теплообменник.
Температура уходящих топочных газов (140…180 °С) считается рентабельной и во многом зависит от состояния внутренней и внешней поверхности нагрева труб котла, экономайзера. Отложение накипи на внутренней поверхности стенок труб котла, а также сажи (летучей золы) на внешней поверхности нагрева существенно ухудшают коэффициент теплопередачи от топочных газов к воде и пару. Увеличение поверхности экономайзера, воздухоподогревателя для более глубокого охлаждения дымовых газов не является целесообразным, так как при этом уменьшается температурный напор ΔТ и увеличивается металлоемкость.
Повышение температуры уходящих топочных газов может произойти в результате неправильного процесса эксплуатации и сжигания топлива: большой тяги (топливо догорает в кипятильном пучке); наличия неплотности в газовых перегородках (газы напрямую идут по газоходам котельного агрегата, не отдавая теплоты трубам – поверхностям нагрева), а также при большом гидравлическом сопротивлении внутри труб (за счет отложения накипи и шлама).
2. Химический недожог
q 3 = (Q 3 / Q р р) ⋅ 100, %.
Потери теплоты от химической неполноты сгорания топлива определяются по результатам анализа летучих горючих веществ Н 2 , СО, СН 4 в уходящих дымовых топочных газах. Причины химической неполноты сгорания: плохое смесеобразование, недостаток воздуха, низкая температура в топке.
3. Механический недожог
q 4 = (Q 4 / Q р р) ⋅ 100, %.
Потери теплоты от механической неполноты сгорания топлива характерны для твердого топлива и зависят от доли провала топлива через колосниковую решетку в систему шлакозолоудаления, уноса частичек несгоревшего топлива с дымовыми газами и шлаком, который может оплавить частицу твердого топлива и не дать ей полностью сгореть.
4. Потери теплоты от наружного охлаждения ограждающих конструкций
q 5 = (Q 5 / Q р р) ⋅ 100, %.
Возникают ввиду разности температуры наружной поверхности теплогенератора и окружающего наружного воздуха. Они зависят от качества изолирующих материалов, их толщины. Для поддержания q 5 в заданных пределах необходимо, чтобы температура наружной поверхности теплогенератора – его обмуровки не превышала 50 °С.
Потери теплоты q 5 уменьшаются по ходу движения топочных газов по газовому тракту, поэтому для теплогенератора введено понятие коэффициента сохранения теплоты
φ = 1 − 0,01q 5 .
5. Потери с физической теплотой шлака
q 6 = (Q 6 / Q р р) ⋅ 100, %.
Возникают за счет высокой температуры шлаков порядка 650 °С, и характерны только при сжигании твердого топлива.
Таблицы расчета тепловых потерь, коэффициента полезного действия брутто, натурального, расчетного и условного расхода топлива теплогенератора приведены в справочной литературе.
Лекция 4
6. Топочные и горелочные устройства
6.1. Топочные устройства
Топка – устройство, предназначенное для сжигания топлива с целью получения теплоты. Топка выполняет функцию горения и теплообменного аппарата – теплота одновременно передается от факела горения излучением и от продуктов сгорания конвекцией к экранным поверхностям, по которым циркулирует вода. Доля лучистого теплообмена в топке, где температура топочных газов порядка 1000 °С, больше чем конвективного, поэтому, чаще всего, поверхности нагрева в топке называют радиационными .
Для сжигания природного газа, мазута и пылевидного твердого топлива используются камерные топки, в конструкции которых можно выделить три основных элемента: топочную камеру, экранную поверхность, горелочное устройство.
1. Топочная камера или топочный объем – пространство, отделенное обмуровкой от окружающей среды.
Обмуровкой называют ограждения, отделяющие топочную камеру и газоходы теплогенератора от внешней среды. Обмуровку в котельном агрегате выполняют из красного или диатомового кирпича, огнеупорного материала или из металлических щитов с огнеупорами.
Внутренняя часть обмуровки топки – футеровка , со стороны топочных газов и шлаков, выполняется из огнеупорных материалов: шамотного кирпича, шамотобетона и других огнеупорных масс. Обмуровка и футеровка должны быть достаточно плотными, особо высокоогнеупорными, стойкими к химическому воздействию шлаков и иметь малый коэффициент теплопроводности.
Обмуровка может опираться непосредственно на фундамент, на металлические конструкции (каркас) или крепиться на трубах экранов топочной камеры и газоходов. Поэтому существуют три конструкции обмуровки: массивная – имеет свой фундамент; накаркасная (облегченная) – фундамента не имеет, крепится на металлический каркас; натрубная – крепится к экранным поверхностям.
Рис. 6.1. Фронтальный и боковой разрез водогрейного котла с топкой и обмуровкой из шамотного кирпича
Каркас служит для крепления и поддержания всех элементов котельного агрегата (барабанов, поверхностей нагрева, трубопроводов, обмуровки, лестниц и площадок) и представляет собой металлические конструкции обычно рамного типа, соединенные с помощью сварки или закрепленные болтами на фундаменте.
2. Экранная радиационная поверхность нагрева выполнена из стальных труб диаметром 51…76 мм, установленных с шагом 1,05…1,1. Экраны воспринимают теплоту за счет радиации и конвекции и передают ее воде или пароводяной смеси, циркулирующим по трубам. Экраны защищают обмуровку от мощных тепловых потоков.
В вертикально-водотрубных котлах (рис. 6.2а) поверхность нагрева состоит из развитого пучка кипятильных труб 2, ввальцованных в верхний 1 и нижний 3 барабаны, топочных экранов 6, питаемых водой из котельных барабанов через опускные трубы 7 и соединительные 4 из камер (коллекторов 5). Испарительные поверхности нагрева котельных агрегатов экранного типа (рис. 6.2б) состоят из барабана 1, системы экранных труб 6 с нижними 8 и 9 и верхними 5 экранными коллекторами, систем опускных 7 и соединительных 10 труб.

Рис. 6.2. Экранные поверхности нагрева котлов:
а – вертикально-водотрубных, б – экранного типа
1 и 3 – верхний и нижний барабаны, 2 и 7 – кипятильные и опускные трубы, 4 и 10 – соединительные трубы, 5, 8 и 9 – коллекторы, 6 – топочные экраны
3. Горелочные устройства устанавливаются на одной или двух противоположных (встречных) поверхностях нагрева, на поду, или в углах топки. На стенах топки котла устраивают амбразуру – отверстие в обмуровке, обмурованное огнеупорным материалом, куда устанавливают воздушный регистр и горелочное устройство.
При любом виде топлива (газообразное, жидкое или пылевидное) воздух в основном (кроме инжекционных горелок) нагнетается дутьевым вентилятором в топку через воздушные регистры или воздухонаправляющие аппараты, что обеспечивает интенсивное завихрение и выход (подачу) топливновоздушной смеси в наиболее узком сечении амбразуры топки со скоростью 25…30 м/с.
Воздухонаправляющее устройство представляет собой лопаточный завихритель осевого типа с подвижными, поворачивающимися вокруг своей оси лопатками. Возможна и установка неподвижных профильных лопаток под углом 45…50° к потоку воздуха. Завихрение потока воздуха интенсифицирует процессы смесеобразования и горения, но при этом увеличивается сопротивление по воздушному тракту. Направляющие аппараты удобны для автоматического регулирования производительности вентиляторов и дымососов.
6.2. Горелочные устройства
В зависимости от вида сжигаемого топлива различают множество конструкций горелочных устройств.
1. При сжигании твердого пылевидного топлива применяют горелки смешивающего типа. В амбразуре топочной камеры устанавливают улитку, в которой пылевоздушная смесь (пылевидное топливо с первичным воздухом) закручивается и по кольцевому каналу транспортируется к выходу горелки, откуда поступает в топку в виде закрученного короткого факела. Вторичный воздух, через другую аналогичную улитку, подается в топку со скоростью 18…30 м/с, в виде мощного закрученного потока, где интенсивно перемешивается с пылевоздушной смесью. Производительность горелок – 2…9 т/ч угольной пыли.
2. При сжигании мазута применяют форсунки и мазутные горелки: механические, ротационные и паровоздушные (паромеханические).
Механическая форсунка . Подогретый примерно до 100 °С мазут под давлением 2…4 МПа поступает в канал, перемещается в насадок (распыливающую головку), где установлен завихритель-распылитель.
Механические центробежные форсунки подразделяются на нерегулируемые и с регулируемым сливом. Следует отметить, что это деление весьма условное: можно изменять подачу у обеих форсунок. К нерегулируемым относят форсунки с малой глубиной регулирования и такие, у которых изменение подачи связано с их выключением, выемкой из топочного устройства и заменой распыливающего элемента.
Механические центробежные форсунки, различающиеся компоновкой распыливающих элементов, дополнительно иногда подразделяют на форсунки со сменными и постоянно работающими на всех режимах распылителями, что обусловлено в основном условиями эксплуатации котла.

Рис. 6.3. Механическая нерегулируемая центробежная форсунка
Механическая регулируемая центробежная форсунка отечественных вспомогательных котлов (рис. 6.3) состоит из корпуса 6 с ручкой 7, ствола 5, представляющего собой толстостенную трубу со штуцером на конце, стопорной втулки 4, распределителя (сопла) 3, распыливающей шайбы 2 и головки 1. Топливо от топливно-форсуночного насоса по отверстиям в корпусе и каналу ствола через сверления в стопорной втулке и распределителе поступает к распыливающей шайбе. Распыливающая шайба у данной конструкции имеет четыре канала 8, расположенных тангенциально к окружности вихревой камеры. По ним топливо устремляется к центру и в вихревую камеру 9, где интенсивно раскручивается. Из нее топливо входит в топку через центральное отверстие 10 в виде вращающегося конуса мелко распыленных частиц.
Поверхности соприкосновения распыливающей шайбы 2 и распределителя 3 тщательно обрабатывают, полируют и при сборке головки прижимают одну к другой стопорной втулкой 4.
Распыливающие шайбы изготавливают из высоколегированных хромоникелевых или хромовольфрамовых сталей. В зависимости от подачи форсунки число тангенциальных каналов может быть от двух до семи.
Форма факела форсунки зависит от отношения f k /f o , в котором f k -суммарная площадь всех тангенциальных каналов, f o - площадь сечения центрального отверстия. Чем меньше это отношение, тем угол конуса распыливания будет больше, а длина факела меньше.
Шайбы изготавливаются обычно под номерами. Каждый номер соответствует определенной подаче, которая указывается в технической документации. Иногда на шайбах указываются числа, соответствующие значениям диаметра центрального отверстия и отношения f k /f o , при этом иностранные фирмы наносят условные обозначения в виде индексов (рис. 6.4). Например: буква X обозначает, что передняя торцевая стенка шайбы изготовлена плоской, буква W - сферической формы; цифра слева - условный номер сверла для изготовления центрального отверстия, цифра справа - отношение f k /f o , увеличенное в 10 раз.

Рис. 6.4. Распыливающая шайба
Ротационная форсунка . Топливо подается через канал и сопло на вращающуюся чашу, дробится и сбрасывается в топочную камеру.

Рис. 6.5. Устройство ротационной газомазутной
горелки РГМГ-10 (-20, -30):
1 – газопровод; 2 – воздушный короб; 3 – кольцо рамы; 4 – газовая труба;
5 , 6 – труба установки запального защитного устройства (ЗЗУ) и фотодатчика; 7 – газовая камера; 8 – переднее кольцо воздухонаправляющего устройства; 9 – конический керамический туннель (амбразура); 10 – завихрители воздухонаправляющего устройства; 11 – ротационная форсунка;
12 – газовые выпускные отверстия; 13 – рамка для центровки завихрителя вторичного воздуха; 14 – опорная труба; 15 – подшипник направляющей рамы; 16 – направляющая рама; 17 – воздушный шибер; 18 – окно для подвода воздуха к завихрителю; 19 – крышка горелки
Давление топлива – мазута составляет 0,15…1 МПа, а чаша вращается со скоростью 1500…4500 об/мин. Воздух поступает вокруг чаши через конус, охватывает вращающийся поток капель и перемешивается с ним. Достоинства: не требуются мощные нефтенасосы и тонкая очистка мазута от примесей; широкий диапазон регулирования (15…100 %). Недостатки: сложная конструкция и повышенный уровень шума.
Паровоздушная или паромеханическая форсунка . Топливо подается в канал, по внешней поверхности которого поступает распыливающая среда – пар или сжатый воздух (давлением 0,5…2,5 МПа).
Пар выходит из канала со скоростью до 1000 м/с и распыливает топливо (мазут) на мельчайшие частички.
Воздух нагнетается вентилятором через амбразуру.
Котельные установки ...
Регистрационный номер ___209 тех/дс СТАНДАРТ
котельные установки , парогенераторы Котельные установки и парогенераторы котельных установок, их...
1 общая характеристика направления подготовки дипломир ованного специалиста по направлению « тепло энергетика»
Перечень образовательных программИ эксплуатация энергетических установок: котлы, котельные установки , парогенераторы , испарители, турбины, вспомогательное тепломеханическое... 240 СД.02 Котельные установки и парогенераторы : общая характеристика современных котельных установок, их...
Составители учебно-тематического плана программы повышения квалификации
ПрограммаМодуль 1 «Водоподготовка»; модуль 2 «Котельные установки и парогенераторы» ; модуль 3 «Паротурбинные установки ТЭС и АЭС»; модуль 4 « ... . ун-т, 2007. 65 с. Модуль 2. «Котельные установки и парогенераторы» Лабораторные работы 1. Раздел 2. Темы 2.1, 2.2, ...
(Реферат)
n1.doc
Топливо и его горение 2
Химический состав топлива. 2
Элементарный анализ топлива. 2
Теплота сгорания топлива. 3
Условное топливо. 3
Газообразное топливо. 4
Жидкое топливо. 4
Твердое топливо. 4
Горение топлива. 5
Горение газообразного топлива. 5
Горение жидкого топлива. 6
Горение твердого топлива. 6
Расчет горения топлива. 7
Расчет горения смеси природного и доменного газов. 9
Исходные данные для расчета 9
Расчет состава природно-доменной смеси. 9
Список использованной литературы 15
Топливо и его горение
Основным источником энергии для металлургической промышленности является топливо.Под топливом понимают вещество, горение которого сопровождается выделением значительного количества тепла и которое отвечает следующим требованиям:
запасы должны быть достаточными для того, чтобы их было экономически выгодно добывать и попользовать;
продукты сгорания должны легко удаляться из зоны горения;
продукты сгорания должны быть безвредны для окружающего мира и самих тепловых устройств;
процесс горения должен быть легко управляем.
Все виды топлива подразделяют на естественное и искусственное, каждое из которых в свою очередь подразделяются на твердое, жидкое, газообразное.
Химический состав топлива.
Топливо состоят из горючей массы и балласта. К горючим компонентам относятся С, Н, S (сера органическая и колчеданная). В состав топлива входят азот N (не горит, теплоноситель), кислород О (окисляет горючие компоненты).Кроме этого в топливе всегда присутствуют вода и зола. Вода, содержащаяся в топливе, подразделяется на гигроскопическую, химически связанную и внешнюю, которая механически удерживается в топливе и теряется при сушке.
Зола – это негорючая минеральная часть топлива, состоящая из Al 2 O 3 , Fe 2 O 3 , Si 2 O 3 , CaO и др.
Элементарный анализ топлива.
| Индекс | Состав |
||||||
| C | H | O | N | S | A | W |
|
| О | органическая масса | ||||||
| Г | горючая масса | ||||||
| С | сухая масса | ||||||
| Р | рабочая масса |
||||||
Состав рабочего топлива:
С Р + H Р + O Р + N Р + S Р + A Р + W Р = 100%
Пересчет состава топлива с любой массы на рабочее топливо выполняется по одному из следующих выражений:


Теплота сгорания топлива.
Количество выделившегося тепла при сжигании топлива связано с химическим составом топлива.Количество тепла, которое выделяется при сжигании единицы топлива, называется теплотой сгорания топлива Q. Ее размерности: кДж/кг (ккал/кг), кДж/м 3 (ккал/м 3) или кДж/кмоль (ккал/кмоль).
В технике различают высшую Q в и низшую Q н теплоту сгорания топлива. Под низшей теплотой сгорания понимают то количество тепла, которое выделяется при сжигании единицы топлива до продуктов полного сжигания при условии, что вода, содержащаяся в продуктах сгорания, находится в виде пара, охлажденного до 20 о С.
Теплота сгорания топлива определяется по следующим формулам:
Для твердого и жидкого топлива:
для газообразного:
,
где C P , H P , CO, H 2 и т.д. – составляющие топлив, %;
4, 187кДж = 1ккал.
Условное топливо.
Для удобства планирования, учета и сравнения различных видов топлива введено понятие условного топлива, которое характеризуется низшей теплотой сгорания.
Для перевода натурального топлива в условное находится эквивалент данного топлива:
Для твердого и жидкого:

Для газообразного:
 .
.
Перерасчет расхода натурального топлива Вр на условное Ву осуществляется по формуле:
Газообразное топливо.
Газообразное топливо по сравнению с твердым и жидким топливом обладает следующими преимуществами:
возможностью лучшего смешения газа с воздухом и, следовательно, сжиганием с меньшим избытком воздуха;
легкостью подогрева перед сжиганием;
отсутствием золы;
транспортабельностью и удобством учета расхода газа;
простотой обслуживания горелочных устройств.
Природный газ – наиболее дешевое топливо. Его основным горючим компонентом является метан CH 4 = 95%.
Искусственные газы:
коксовый газ – продукт коксования углей;
 МДж/м 3 ;
МДж/м 3 ;Жидкое топливо.
Естественное жидкое топливо – нефть. Как топливо ее используют редко.Искусственное жидкое топливо – это продукты переработки нефти: бензин, лигроин, керосин, газойль и др. Остаток переработки – мазут. Мазут – топливо металлургической промышленности и энергетики. Перед сжиганием мазут нагревают до 70-80 о С с целью понижения его вязкости. Состав мазута – это соединения углеродов. С = 85-88%; Н 2 = 10%;  МДж/кг.
МДж/кг.
Твердое топливо.
Это каменный и бурый угли, антрацит, горючие сланцы, торф.Основной метод переработки угля – коксование, заключающийся в сухой перегонке топлива путем нагрева угля без доступа воздуха при температурах 900-1100 о С в коксовых печах. Получается спекшийся кокс, пористый, механически прочный, применяемый в металлургии, в основном для выплавки чугуна. Содержание С=75-85%;  МДж/кг.
МДж/кг.
Горение топлива.
Горением называют химический процесс соединения топлива с окислителем, сопровождающийся интенсивным тепловыделением и быстрым подъемом температуры продуктов сгорания.Объем движущихся газов, в котором совершаются процессы горения, называется пламенем.
В зависимости от величины коэффициента расхода n (отношение действительного расхода к теоретическому), условий смешения окислителя и топлива, горение топлива бывает полное или неполное.
Полное горение топлива получается при n ? 1 и полном смешении топлива с окислителем.
Неполное горение:
химический недожог получается при n ? 1;
механический недожог получается при n ? 1 из-за плохого смешения окислителя с топливом, кроме того, унос частиц с газом, провалом твердого топлива сквозь колосниковую решетку.
Следует помнить, что основную роль для обеспечения полного сжигания топлива при n ? 1 играет стадия смешения топлива с окислителем.
Горение газообразного топлива.
Процесс горения любого топлива разделяется на две стадии: воспламенение и непосредственное горение.Полное сгорание основных горючих составляющих газообразных топлив происходит по следующим реакциям:
CH 4 + 2O 2 = CO 2 + 2H 2 O + 8580ккал/нм 3 ;
H 2 + ЅO 2 = H 2 O + 2580ккал/нм 3 ;
CO + ЅO 2 = CO 2 + 3022ккал/нм 3 .
Неполное горение метана:
СН 4 + ЅО 2 = СО + 2Н 2 + 396ккал/нм 3 .
Горение газообразного топлива бывает кинетическое и диффузорное:
под кинетическим горением понимают горение газовой смеси горючего и окислителя; в этом случае полное время процесса определяется только скоростью химической реакции;
при диффузорном горении процессы смешения и горения происходят в одном объеме; лимитирующим процессом является процесс смешения – физический процесс, протекающий с меньшей скоростью, чем собственно процесс горения.
Горение жидкого топлива.
В условиях промышленных печей жидкое топливо (обычно мазут) сжигают в распыленном состоянии. Кинетика горения: жидкое топливо, распыленное до мелких капель, попадая в пространство печи, нагретое выше температуры самовоспламенения, начинает испаряться, дальше смешивается с окислителем и горит.Горение твердого топлива.
Процесс горения твердого топлива может быть разделен на следующие стадии:
подогрев и подсушка топлива;
процесс пирогенного разложения топлива с выделением летучих и образованием коксового остатка;
горение летучих, горение коксового остатка (углерод).
С + О 2 = СО 2 + 7980ккал/(кг о С);
Неполное горение углерода:
2С + О 2 = 2СО + 2340ккал/(кг о С).
Расчет горения топлива.
Для удобства расчет горения твердого и жидкого топлива ведется на 100кг топлива, а расчет горения газообразного топлива на 100м 3 .При расчете делают следующие допущения:
смешение окислителя с горючим идеальное, и горение идет до полного сгорания топлива (до СО 2 и Н 2 О);
в системе достигнуто термодинамическое равновесие;
диссоциация продуктов сгорания и горючих принимается равной нулю.
Целью расчета является определение:
количества необходимого для горения воздуха или дутья, обогащенного кислорода.
Действительный расход L д для более полного сжигания обычно теоретический L т, т.к. в реальных условиях газогорелочными устройствами не обеспечивается идеальное смешение.
Отношение  называется коэффициентом расхода воздуха.
называется коэффициентом расхода воздуха.
количества состава и плотности образующихся продуктов сгорания.
температуры горения.
действительная температура – это та температура, которую имеют продукты сгорания в конкретных условиях процесса сжигания топлива, она определяется по формуле:
 ,
,
где  – пирометрический коэффициент (определяется экспериментально);
– пирометрический коэффициент (определяется экспериментально);
Для топочных камер = 0,95;
Для мартеновских печей = 0,85-0,9;
Для садочных печей = 0,8-0,85;
Для проходных и протяжных = 0,7-0,75;
T k – калориметрическая температура горения, о С.
теоретическая температура горения определяется с учетом диссоциации в продуктах сгорания:
 ,
,
где  – теплота сгорания топлива, кДж/м 3 или кДж/кг;
– теплота сгорания топлива, кДж/м 3 или кДж/кг;
Q дисс – тепло, пошедшее на процесс диссоциации, кДж;
V П.Г. – объем продуктов сгорания, образующихся при сгорании единицы топлива, м 3 ;
С П.Г. – объемная теплоемкость продуктов сгорания, кДж/(м 3 о С).
калориметрическая температура определяется из условия, что все выделившееся при горении тепло расходуется на повышении температуры продуктов сгорания (т.е. для адиабатных условий):
,
где  – физическое тепло подогретого воздуха, кДж/м 3 или кДж/кг;
– физическое тепло подогретого воздуха, кДж/м 3 или кДж/кг;
 – физическое тепло подогретого топлива. кДж/м 3 или кДж/кг;
– физическое тепло подогретого топлива. кДж/м 3 или кДж/кг;
L д – объем воздуха на единицу топлива, м 3 /м 3 или м 3 /кг;
С В и С Г – средние теплоемкости воздуха и топлива, кДж/(м 3 о С).
Калориметрическую температуру находим методом последовательных приближений, используя понятие энтальпии.
Начальная энтальпия продуктов сгорания определяется по формуле: ,
,
По значению  задаемся возможным значением температуры горения 1 и при этой температуре находим энтальпию продуктов сгорания. Если
задаемся возможным значением температуры горения 1 и при этой температуре находим энтальпию продуктов сгорания. Если  , то истинная калориметрическая температура ниже, чем
, то истинная калориметрическая температура ниже, чем  . Поэтому задаемся температурой
. Поэтому задаемся температурой  и снова находим энтальпию продуктов сгорания. Если
и снова находим энтальпию продуктов сгорания. Если  , то действительная калориметрическая температура продуктов сгорания лежит в интервале
, то действительная калориметрическая температура продуктов сгорания лежит в интервале  и может быть найдена по формуле:
и может быть найдена по формуле: .
.
Окончательное значение t k следует перевести в градусы Кельвина.
Расчет горения смеси природного и доменного газов.
Исходные данные для расчета
t Г = 400 о С = 673К;
Температура уходящих продуктов сгорания (дыма): t П.Г. = 840 о С = 1113К;
Расчет ведется на 1м 3 газа.
Расчет состава природно-доменной смеси.
1. Пересчет состава сухого доменного газа на влажный.Объемный процент водяных паров во влажном доменном газе:
.
Коэффициент пересчета состава сухого доменного газа во влажный (рабочий): .
.
Рабочий состав доменного газа:
;
.
Таблица 1. Состав рабочего доменного газа.
| Газ | СН 4 | СО 2 | H 2 | CO | N 2 | H 2 O | ? |
| Доменный | 0,285 | 12,039 | 1,337 | 25,596 | 55,553 | 5,19 | 100 |
2. Определение теплоты сгорания газов .
Природного газа:
.
Доменного газа:
.
3. Расчет состава смеси природного и доменного газов.
Принимаем долю доменного газа в природно-доменной смеси (ПДС) за x, тогда доля природного газа будет равна y = (1-x). Составляем уравнение:
,
где  – исходная теплота сгорания смеси газов, МДж/м 3 .
– исходная теплота сгорания смеси газов, МДж/м 3 .
Находим, что .
.
у = (1-х) = 1-0,747 = 0,253.
Состав смешанного газа, %.
;
Таблица 2. Состав природно-доменной смеси.
| CO | CO 2 | CH 4 | C 2 H 6 | C 3 H 8 | C 4 H 10 | N 2 | H 2 | H 2 O | ? |
| 20,48 | 9,1196 | 21,7877 | 1,0314 | 0,7448 | 0,4641 | 41,0975 | 1,0185 | 3,8769 | 100 |
Проверка:
Погрешность: 0,004%.
4. Плотность ПДС и воздуха.
Плотность ПДС. .
.
Плотность воздуха.
5. Расход воздуха, необходимого для сжигания единицы топлива.
Теоретический расход воздуха (n = 1).
Действительный расход воздуха (n = 1,14).
6. Расчет количества и состава продуктов сгорания.
Объем углекислого газа в ПГ:
Объем водяных паров в ПГ:
Объем азота в ПГ:
Объем избыточного кислорода в ПГ:
Общее количество ПС:
Состав ПС:


![]()
Таблица 3. Состав продуктов сгорания.
| Продукты сгорания | СО 2 | Н 2 О | N 2 | O 2 | ? |
| % | 13,1626 | 12,8199 | 71,9703 | 2,0472 | 100 |
Плотность ПС:
7. Материальный баланс процесса горения.
| Приход, кг | Расход, кг | Невязка баланса, % |
| 1. Газ:
| Продукты сгорания: |  |
| 2. Воздух:
|
||
| Всего: 5,728кг | 5,723кг |
8. Определение калориметрической температуры горения.
Находим начальную энтальпию продуктов сгорания  по формуле, где известно физическое тепло подогретого газа и воздуха.
по формуле, где известно физическое тепло подогретого газа и воздуха.
Физическое тепло газа:
где  – теплоемкость подогретого газа при t = 400 o C, найденная по формуле:
– теплоемкость подогретого газа при t = 400 o C, найденная по формуле:
где:
Физическое тепло подогретого воздуха:
.
Начальная энтальпия продуктов сгорания: .
.
По величине , используя таблицу №7 (там же), находим приближенное значение  .
.
Определяем энтальпию продуктов горения при этой температуре:![]()


Значения  ,
,  и т.д. находим из таблицы №6 (там же).
и т.д. находим из таблицы №6 (там же).
Полученное значение  , значит,
, значит, ![]() .
.
Находим  – энтальпию продуктов сгорания при 2000 о С:
– энтальпию продуктов сгорания при 2000 о С:


Получилось, что  , т.е. действительно калориметрическая температура
, т.е. действительно калориметрическая температура  лежит в интервале
лежит в интервале  (
( ), которая равна:
), которая равна: .
.

Горючая масса Буланашского каменного угля.
Состав горючей массы угольной пыли, массовые %
|
С г |
Н г |
О г |
N г |
S г | |
Температура подогрева вторичного воздуха t возд = 400°С, доля первичного (холодного) воздуха 30%. Температура угольной пылиt топл = 50°С.
Определяем состав рабочего топлива.
А
р
= А
с
= 24,0 = 23,5%
= 23,5%
С
р
= С
г
 = 80,5
= 80,5 = 80,5·0,745 =60,0%;
= 80,5·0,745 =60,0%;
Н р = 5,5 . 0,745 = 4,1%;
N р = 1,5 . 0,745 = 1,1%;
О р = 11,2 . 0,745 = 8,3%;
S р = 1,3 . 0,745 = 1,0%.
Результаты пересчета состава сводим в таблицу.
Состав рабочего топлива
Определяем теплоту сгорания рабочего топлива по формуле (0):
 = 339 · 60,0 + 1030 · 4,1
108,9 (8,3
1,0)
25 · 2,0= 23732 кДж/кг.
= 339 · 60,0 + 1030 · 4,1
108,9 (8,3
1,0)
25 · 2,0= 23732 кДж/кг.
Тепловой эквивалент согласно формуле (0) составляет:
Э
т = = 0,810.
= 0,810.
Находим теоретически необходимое количество сухого воздуха по формуле (0):
L 0 = 0,0889 · 60,0 + 0,265 . 4,10,0333 (8,31,0) = 6,18 нм 3 /кг.
Определяем действительное количество воздуха при = 1,2:
L д = 1,2 · 6,18 = 7,41 нм 3 /кг.
Определяем количество атмосферного воздуха:
L д = (1 + 0016d )L д = 1,016 · 7,41 = 7,53 нм 3 /кг.
Определяем состав продуктов горения по формулам (0) – (0):
V СО 2 = 0,01855 · 60,0 = 1,113 нм 3 /кг;
V S О 2 = 0,007 · 1,0 = 0,007 нм 3 /кг;
V Н 2 О = 0,112 . 4,1 + 0,0124 . 2,0 + 0,0016·10·7,41 = 0,603 нм 3 /кг;
V N 2 = 0,79 . 7,41 + 0,008 . 1,1 = 5,863 нм 3 /кг;
V О 2 = 0,21 . 0,2 . 6,18 = 0,260 нм 3 /кг.
Общий объем продуктов горения при = 1,2 по формуле (0):
V = 1,113 + 0,007 + 0,603 + 5,863 + 0,260 = 7,85 нм 3 /кг.
Процентный состав продуктов горения:
CO 2
=
 ·100%
= 14,2%;
SO 2
=
·100%
= 14,2%;
SO 2
=
 ·100%
= 0,1%;
·100%
= 0,1%;
Н 2 O
=
 ·100%
= 7,7%;
N 2
=
·100%
= 7,7%;
N 2
=
 ·100%
= 74,7%;
·100%
= 74,7%;
О 2 = ·100%
= 3,3%. Всего 100,0 %.
·100%
= 3,3%. Всего 100,0 %.
Составляем материальный баланс процесса горения на 100 кг угольной пыли при = 1,2.
Материальный баланс процесса горения угольной пыли
|
Зола (шлак) | |||
|
Продукты горения | |||
|
O 2 = 100 . 7,41 . 0,21 . 1,429 |
CO 2 = 100 . 1,113 . 1,977 | ||
|
N 2 = 100 . 7,41 . 0,79 . 1,251 |
H 2 O= 100 . 0,603 . 0,804 | ||
|
H 2 О = 100 . 0,0016 . 10 . 7,41 . 0,804 |
N 2 = 100 . 5,859 . 1,251 | ||
|
O 2 = 100 . 0,26 . 1,429 | |||
|
SO 2 = 100 . 0,007 . 2,852 | |||
Невязка баланса составляет:
 = 0,056%.
= 0,056%.
Определяем теоретическую температуру горения угольной пыли. Для этого находим общее теплосодержание продуктов горения с учетом подогрева угольной пыли до 50°С (теплоемкость С уг.пыли = 0,92 кДж/(кг К)) и подогрева вторичного воздуха (70% от общего количества воздуха). Поi – t -диаграмме (рис. 1) находим теплосодержание воздуха приt возд = 400°С:i возд. = 536 кДж/нм 3 , тогда по формуле (0):
i
общ =
 +
+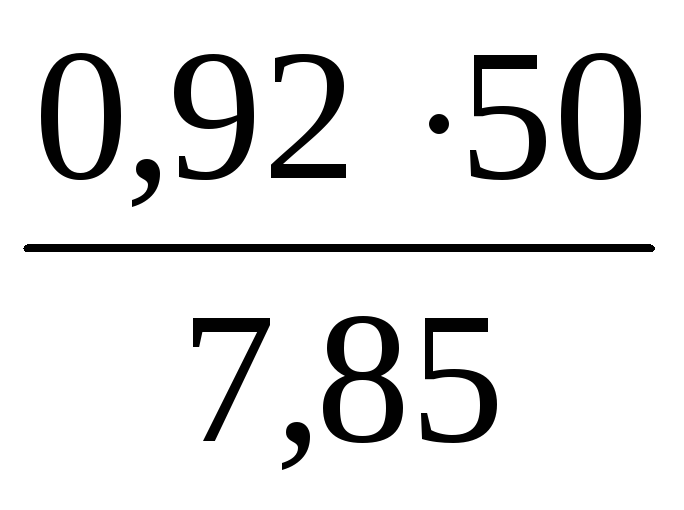 +
+ = 3393 кДж/нм 3 .
= 3393 кДж/нм 3 .
По i – t -диаграмме находим теоретическую температуру горения (при коэффициенте= 1,20)t теор = 1970°С.
Расчетное теплосодержание продуктов горения с учетом пирометрического коэффициента = 0,75:
i общ = i общ . = 3393 . 0,75 = 2545 кДж/нм 3 .
По i – t -диаграмме (рис. 2) находим действительную температуру горенияt действ = 1570°С.
3.4.1 Горение газообразного топлива
Горение газов происходит в объеме и относится к гомогенному горению. Оно может происходить как в кинетической, так и в диффузионной области.
3.4.1.1 Кинетическое горение
После того, как произошло воспламенение, наступает процесс распространения пламени, связанный с постоянной передачей тепла от сгоревших к новым порциям топлива. Подобная передача тепла определяется законами теплопроводности и диффузии, и сильно зависит от характера пламени. Если пламя распространяется в неподвижной смеси или смеси, движущейся ламинарно, то основной формой передачи тепла будет молекулярная теплопроводность. Подобный чисто теплопроводный процесс получил название нормального горения.
При турбулентном движении газо – окислительной смеси большую роль приобретает турбулентная диффузия. При некоторых условиях распространение пламени происходит с огромной скоростью и имеет характер взрывной волны. Подобное распространение пламени получило название детонационного горения или просто детонации.
Важнейшими факторами, влияющими на скорость распространения нормального горения, являются состав горючей смеси, предварительная температура подогрева смеси или отдельных ее компонентов и давление.
Для всех горючих газов существует оптимальное соотношение газа и воздуха, при котором скорость нормального горения достигает максимальной величины. При этом максимум скорости нормального горения никогда не соответствует стехиометрическому соотношению, а всегда смещен в сторону избыточного содержания газа в горючей смеси. Температура горения (или тепловыделение) достигает своего наибольшего значения именно при стехиометрическом соотношении.
Горение при турбулентном режиме более распространенный случай в металлургической практике, чем горение в спокойной или ламинарно движущейся среде. На скорость турбулентного горения и на состояние фронта горения большое влияние оказывает общий уровень турбулентности потока и сам процесс горения, поскольку при определенных условиях возникает неустойчивость фронта горения.
3.4.1.2 Диффузионное горение
В настоящее время широко распространен диффузионный метод сжигания газообразного топлива, при котором смешение и горение происходят в одном объеме. И при кинетическом, и при диффузионном горении образуется фронт горения, в котором горючее и окислитель находятся в стехиометрическом соотношении. Достижение стехиометрического соотношения, которое при наличии постоянного поджигателя (в металлургических печах всегда есть поджигатель) обеспечивает необходимые условия для протекания процесса горения, зависит от характера перемешивания топлива с воздухом. Поэтому процессы смешения при диффузионном горении играют первостепенную роль.
Диффузионные пламена имеют сложный турбулентный характер и изучены пока недостаточно.
3.4.2 Горение жидкого топлива
В условиях промышленных печей жидкое топливо сжигают в распыленном состоянии.
Процесс горения жидкого топлива складывается из следующих стадий:
Распыливание,
Воспламенение, которому предшествует и способствует процесс смешения, подогрева и испарения,
Горение капли жидкого топлива.
Процесс распыливания топлива основан на дроблении жидкости распылителем. Дробление будет происходит в том случае, если давление движущегося распылителя будет превышать действие поверхностного натяжения.
Воспламенение жидкого топливапроисходит так: жидкое топливо, попав в среду с высокой температурой, начинает испаряться. Около поверхности капли образуется паро – воздушная смесь, которая воспламеняется первой. Температура, при которой происходит воспламенение паро – воздушной смеси, называется температурой вспышки топлива. Обычно температура кипения жидкого топлива ниже температуры воспламенения.
Горение капли. Все процессы, из которых складывается горение топлива, совершаются или на поверхности, или около поверхности капли.
Температура кипения жидких топлив всегда ниже температуры воспламенения, поэтому горение жидкого в основном происходит в паровой фазе. Процессы горения паро – воздушной смеси и испарения тесно связаны между собой. При горении жидкого топлива осуществляется теплообмен между газовой средой и поверхностью жидкости, т. е. между средами, находящимися в разных агрегатных состояниях, что придает всему процессу гетерогенный характер
Общее время горения капли находят из анализа изменения размеров капли в связи с процессами тепло – и массопереноса. Оно прямо пропорционально плотности, размеру капли и скрытой теплоте капли и обратно пропорционально теплопроводности капли, а также перепаду температур между газовой средой и поверхностью капли.
3.4.3 Горение твердого топлива
Горение твердого топлива относится к гетерогенному.
Процесс горения твердого топлива складывается из следующих стадий:
Подогрев и подсушка топлива,
Процесс пирогенного разложения топлива с выделением летучих и образованием коксового остатка,
Горение летучих,
Горение коксового остатка.
Процесс выделения летучих, т. е. горючей смеси различных газообразных составляющих – Н 2 , СО, СН 4 , С m H n и др., протекает при подогреве топлива до 200 ˚С и выше. Температура начала выделения летучих зависит от возраста угля. Чем "старше" уголь, чем выше в нем содержание углерода, тем при более высокой температуре начинается процесс выделения летучих. Летучие в процессе горения твердого топлива играют важную роль, которая различна при горении кускового топлива и угольной пыли.
При горении кускового топлива летучие выделяются при сравнительно умеренных температурах, смешиваются с воздухом и воспламеняются первыми. Таким образом, горением летучих начинается процесс горения всего топлива. Тепло, выделяемое при горении летучих, способствует повышению температуры и дальнейшему развитию процесса горения. Горение углерода начинается уже после завершения выхода летучих. Процесс горения самого углерода продолжителен и он определяет время протекания всего процесса.
При сжигании угольной пыли в связи с огромной суммарной поверхностью угольных частиц основная масса летучих не успевает выделиться до момента воспламенения частиц, поэтому летучие сгорают вместе с углеродом.
3.4.4 Расчеты горения топлива
При сжигании топлива в промышленных печах в качестве окислителя используют кислород, содержащийся в воздухе или в обогащенном кислородом дутье. В результате горения образуются продукты сгорания и развивается определенная температура.
3.4.4.1 Определение расхода воздуха
Расход воздуха можно определять в объемных единицах и в единицах массы. В объемных единицах рассчитывают газообразное топливо, в единицах массы – жидкое и твердое топливо.
В качестве примера рассмотрим горение топлива, состоящего из 98 % СН 4 и
СН 4 + 2 О 2 = СО 2 + 2 Н 2 О,
из которой следует, что для сжигания 1 кмоль СН 4 требуется 2 кмоль О 2 . Но объем 1 кмоль любого газа одинаков для всех газов и при нормальных условиях равен 22,4 м 3 , следовательно для сжигания 1 м 3 СН 4 требуется 2 м 3 О 2 . В рассматриваемом примере в 1 м 3 газа содержится 0,98 м 3 СН 4 , для сжигания которого потребуется 0,98 ∙ 2 = 1,96 м 3 О 2 . В сухом воздухе доля кислорода по объему составляет 21 %, а остальные 79 % приходится практически полностью на азот. Значит, количество азота в воздухе в 79/21=3,76 раза больше количества кислорода. Поэтому расход воздуха для сжигания 1 м 3 газа указанного состава будет равен 1,96 + 1,96 ∙ 3,76=1,96 + 7,38 = 9,34 м 3 .
При горении топлива полученные на основе химических реакций количества кислорода и воздуха представляют те наименьшие количества, которые необходимы для полного окисления единицы горючего вещества. Такое наименьшее необходимое количество воздуха называют теоретическим. на прктике для более полного сжигания требуется подавать количество воздуха, несколько превышающее теоретическое. Величина показывающая отношение действительного расхода воздуха к теоретическому расходу называют коэффициентом расхода воздуха.
Изменение величины коэффициента расхода воздуха влечет за собой изменение количества воздуха, подаваемого для горения. Так, для рассмотренного выше примера горения газа при n=1,2 потребуется
1,96 ∙ 1,2 = 2,35 м 3 О 2 и 2,35 + 2,35 ∙ 3,76 = 11,19 м 3 воздуха.
3.4.4.2Определение количества и состава продуктов сгорания
Рассмотрим пример горения газа (98 % СН 4 и 2 % N 2) сначала при коэффициенте расхода воздуха, равным 1. Определим последовательно количества каждой составляющей продуктов сгорания. При сжигании 1 м 3 СН 4 образуется 1 м 3 СО 2 и 2 м 3 Н 2 О, а при сжигании 0,98 м 3 СН 4 образуется 0,98 м 3 СО 2 и 1,96 м 3 Н 2 О.
Кроме того, вносится азота:
с воздухом. . . . . 1,96 ∙ 3,76 = 7,38
с газом. . . . . . . . . . . . . . . . . . . 0,02
––––––––––––––––––––––
Итого. . . . . 7,40
Полное количество продуктов сгорания составит 0,98 + 1,96 + 7,40 = 10,34 м 3 .
СО 2 . . . . . . . .  ∙ 100 = 9,45
∙ 100 = 9,45
Н 2 О. . . . . . . .  ∙ 100 = 18,9
∙ 100 = 18,9
N 2 . . . . . . . . .  ∙ 100 = 71,65
∙ 100 = 71,65
При сжигании газа с коэффициентом расхода воздуха, большем единицы, количество и состав продуктов сгорания изменяются. Например, при n = 1,2 в продуктах сгорания рассматриваемого состава будет 0,98 м 3 СО 2 ; 1,96 м 3 Н 2 О; 1,96 ∙ 1,2 – 1,96 = 0,39 м 3 О 2 и 1,96 ∙ 1,2 ∙ 3,76 + 0,02 = 8,86 м 3 N 2 .
Полное количество продуктов сгорания составит 0,98 + 1,96 + 0,39 + 8,86 = 12,19 м 3 .
Состав продуктов сгорания будет следующий, %:
СО 2 . . . . . . . . ∙ 100 = 8,05
Н 2 О. . . . . . . .  ∙ 100 = 16,1
∙ 100 = 16,1
О 2 . . . . . . . . . .  ∙ 100 = 3,2
∙ 100 = 3,2
N 2 . . . . . . . . .  ∙ 100 = 72,65
∙ 100 = 72,65
–––––––––––––––––––––––––––––––
Итого. . . . . . . . . . . . . 100
При расчетах горения необходимо составлять материальный баланс, определяя массы исходных веществ и образующихся продуктов сгорания. Для рассмотренного выше примера горения в воздухе газа (98 % СН 4 и 2 % N 2) при n = 1 материальный баланс будет выглядеть следующим образом:
Поступило, кг: Получено, кг:
СН 4 . . . . .0,98 ∙ 16 / 22,4 = 0,7 СО 2 . . . . . . 0,98 ∙ 44 / 22,4 = 1,925
О 2 . . . .. . .1,96 ∙ 32 / 22,4 = 2,8 Н 2 О. . . . . .1,96 ∙ 18 / 22,4 = 1,575
N 2 . . (7,38 + 0,02) ∙ 28 / 22,4 = 9,25 N 2 . . . . . . . . 7,4 ∙ 28 / 22,4 = 9,25
–––––––––––––––––––––––––––––– ––––––––––––––––––––––––––––––
Итого. . . . . . . . . . 12,75 Итого. . . . . . . . . . . . 12,75
При составлении материального баланса погрешность не должна превышать 5 %.
3.4.4.3Определение температуры горения
Под температурой горения понимают ту температуру,которую приобретают продукты сгорания в результате сообщения им тепла, выделенного при сжигании. Различают теоретическую и калориметрическую температуры горения.
Теоретическую температуру горения t т определяют с учетом процессов диссоциации, протекающих при образовании продуктов сгорания:
где - теплота сгорания топлива, кДж/м 3 или кДж/кг;
q дисс – тепло, израсходованноеина процессы диссоциации, кДж/м 3 или кДж/кг;
V пр – объем продуктов сгорания, образующихся при сгорании единицы топлива,
с – объемная теплоемкость продуктов сгорания, кДж/(м 3 ∙ град) или
кДж/(кг ∙ град).
Калориметрическую температуру t к определяют из условия полного сгорания топлива и использования всего выделившегося при горении тепла только на повышение температуры продуктов сгорания при адиабатных условиях (отсутствие теплообмена с внешней средой) и n = 1.
При подогретом воздухе (или топливе) калориметрическую температуру определяют по выражению:
где Q ф – физическое тепло подогретых воздуха и топлива.
Газообразные продукты сгорания любого топлива представляют собой смесь различных газообразных составляющих. Каждой из этих составляющих при той или иной температуре присуща определенная величина теплоемкости. Это дает возможность определить теплоемкость теплоемкость продуктов сгорания в целом для соответствующей температуры. Например, теплоемкость продуктов сгорания, состоящих из 9,45 % СО 2 , 18,9 % Н 2 О и 71,65 % N 2 при температуре 1500 ˚ С может быть определена следующим образом.
Объемные теплоемкости при этой температуре составят:
для СО 2 2,3636 кДж/(м 3 ∙ град),
для Н 2 О 1,8389 кДж/(м 3 ∙ град),
для N 2 1.447 кДж/(м 3 ∙ град).
В 1 м 3 продуктов сгорания содержится 0,0945 м 3 СО 2, 0,189 м 3 Н 2 О, 0,7165 м 3 N 2 .
Следовательно, теплоемкость 1 м 3 продуктов сгорания будет равна:
СО 2 . . . . . .2,3636 ∙ 0,0945 = 0,223
Н 2 О. . . . . . 1,8389 ∙ 0,189 = 0,348
N 2 . . . . . . . .1,447 ∙ 0,7165 = 1,035
–––––––––––––––––––––––––––––
Итого. . . . . .. . . . . . 1,606
Кроме теплоемкостей пользуются также величинами энтальпий. Энтальпия представляет собой произведение теплоемкости газа при постоянном давлении на температуру:
i = с р t кДж/м 3 .
Например, энтальпия СО 2 при температуре 1500 ˚ С равна:
i (СО 2) = 2,3636 ∙ 1500 = 3545,34 кДж/м 3 .
3.4.4.4Основные формулы для расчета горения топлива
Сведем все формулы, необходимые для расчета горения топлива, в единую таблицу.
Таблица 3.2 – Основные формулы для расчета горения топлива
| Искомый параметр | Жидкое и твердое топливо | Газообразное топливо |
| Пересчет на рабочий состав | | |
| Состав смеси |
где |
|
| Низшая теплота сгорания | ||
| Таблица 3.2 Продолжение | ||
| Расход кислорода на горение при n=1 | V(О 2)=0,01(1,867С Р +5,6Н Р + +0,7(S Р -О Р)) | V(О 2)=0,01(0,5(СО+Н 2 +3Н 2 S)+∑(n+m/4)С n Н m) |
| Расход сухого воздуха | V В =n(1+k)V(О 2), где k=79/21=3,76;n – коэффициент расхода воздуха | |
| Объемы компонентов продуктов сгорания | V(RО 2)=0,01(1,867С Р +0,7S Р) RО 2 =СО 2 +SО 2 V(Н 2 О)=0,01(11,2Н Р + +1,242W Р) V(N 2)=0,008N Р +nkV(О 2) V(О 2)"=(n-1)V(О 2) | V(RО 2)=0,01(СО 2 +SО 2 +СО+ +Н 2 S+∑nС n Н m) V(Н 2 О)=0,01(Н 2 О+Н 2 + Н 2 S+ +0,5∑mС n Н m) V(N 2)=0,01N 2 +nkV(О 2) V(О 2)"=(n-1)V(О 2) |
| Объем продуктов сгорания | V ПС = V(RО 2)+ V(Н 2 О)+ V(N 2)+ V(О 2)" | |
| Калориметрическая температура горения | |
|
| Энтальпия продуктов сгорания | Истинная
 При температуре t К "
При температуре t К "
|
|
| Действительная температура продуктов сгорания | t Д =η пир t К, где η пир - пирометрический коэффициент для топочных камер η пир =0,95 для мартеновских печей η пир =0,85 – 0,9 для садочных печей η пир =0,8 – 0,85 для проходных и протяжных печей η пир =0,7 – 0,75 |

 %.
%. %,
%,